茶树[Camellia sinensis (L.) O. Kuntze]是一种重要的多年生木本常绿经济作物,它的叶片经过不同的工艺可以制作出各种各样的茶类[1]。而茶作为世界上主要的非酒精类饮品,由于其独特的口感和广泛的健康益处越来越受到人们的欢迎。茶树起源于我国的西南地区,目前已在世界上超过52个国家和地区广泛种植[2]。虽然大部分的茶树叶片都是绿色的,但是在长期的进化和人工选育过程中,一些叶色特异的茶树资源逐渐被发掘出来,比如紫(红)色叶片茶树资源、白化叶片茶树资源以及黄化叶片茶树资源等(图1)。这些叶色特异茶树资源除了叶片颜色有别于一般茶树之外,它们的叶片内含物成分也和一般茶树具有明显不同,形成了独具特色的茶产品[3,4]。
叶色特异茶树资源不仅为茶树育种实践提供了珍贵的遗传材料,同时也为茶树分子生物学研究提供了特色材料基础。近年来,利用现代分子生物学技术手段,许多研究者以这些叶色特异茶树资源为材料开展了大量有意义的研究。这些研究不仅有助于我们明晰这些特异茶树资源的分子基础,而且一定程度上也推动着茶树分子生物学研究的发展。本文将聚焦于2016年以来发表于国际公开期刊上的对叶色特异茶树资源的主要研究成果,重点对紫色、黄化、白化芽叶茶树资源分子层面的相关研究及研究结果作一简要概述,以期揭示茶树分子生物学的研究现状并对其后续发展进行展望。

图1. 不同叶色茶树品种的叶片形态。
QC1:绿色叶片品种‘黔茶1号’;BY1:白化叶片品种‘白叶1号’(‘安吉白茶’);HJY :黄化叶片品种‘黄金芽’;ZJ:紫色叶片品种‘紫娟’。
1 紫色芽叶茶树资源研究进展
不同于一般茶树资源顶端芽叶会季节性的出现紫(红)色,紫色芽叶特异茶树资源的新稍通常全年保持紫(红)色。紫色茶树叶片中花青素、茶多酚以及总儿茶素的含量较高[5],比如紫芽品种‘紫娟’的叶片中花青素的含量在干叶中可以达到707ug/g,是普通茶树叶片花青素含量的10倍以上[6,7]。花青素属于黄酮类化合物,富含花青素的茶树叶片制出的茶品质并不好,但是因为花青素能够有效清除自由基并诱导机体产生强抗氧化活性等保健功能[4,6,7],紫芽制出的茶产品受到了消费者的特别关注。
在茶树中,花青素主要通过类黄酮代谢途径参与儿茶素类的生成[8](图2),而儿茶素类是茶叶的主要次生代谢物质,同时也是茶叶品质的主要功能成分[9,10]。目前对紫色芽叶茶树资源的研究多集中于花青素合成与调控的分子机制以及相关基因的功能解析方面。
1.1 从表型到组学研究
‘紫娟’是从云南大叶种中选育出来的一个紫色芽叶茶树品种,它的新稍呈现紫(红)色,而成熟叶片伴随生长逐渐转绿,其紫叶中花青素主要成分是矢车菊素(cyanidin-3-O-galactoside)和飞燕草素(delphinidin-3-O-galactoside)[11]。Li等[12]利用RNA-seq技术从‘紫娟’的紫叶和绿叶中鉴定到了2250个差异表达基因,其中1270个在紫叶中上调表达、980个下调表达,这些差异表达基因主要涉及碳代谢、花青素合成和运输等代谢途径,其中花青素合成途径相关基因PAL、C4H、4CL、CHS、F3’5’H、DFR、ANS、UGT等在紫叶中都上调表达;另外蔗糖合酶 (SUS)、乙酰辅酶A羧酶 (ACCase)、PAL等酶活性与叶片中花青素含量呈现正相关。还有研究者利用iTRAQ技术从蛋白表达层面对‘紫娟’的紫叶和绿叶中的差异表达蛋白进行了鉴定,与转录组结果类似,CHS、CHI、DFR 、ANS、UGT等蛋白在紫叶中也显著上调表达,表明花青素合成途径相关基因的表达促进花青素的积累,虽然紫叶中PAL蛋白的上调表达没有达到显著水平,但是酶活性却显著提高,预示着PAL促进花青素积累主要依靠酶活性而不是酶丰度,该研究还显示bHLH和HY5转录因子可能通过促进花青素合成途径基因的表达促进紫叶中花青素的积累[6]。
不同的紫叶茶树品种其叶色的调控机制也存在着差异。Shen等[13]对比分析了‘紫娟’和另一紫叶品种‘Zixin’的叶片颜色变化过程中代谢物的变化情况,发现前者叶片颜色转绿过程中主要是类黄酮/花青素的减少,而后者除此之外还伴随着卟啉及叶绿素代谢的增强、类胡萝卜素合成增加、脂肪酸较少以及类固醇的增加。Zhou等[14,15]分别利用cDNA-AFLP和2-DE技术从基因表达和蛋白表达层面对紫叶品种‘武夷奇枞18’其叶色变化的机制进行了研究,前者共鉴定到148个差异表达基因,除了涉及黄酮类和花青素的合成外,还涉及细胞呼吸、光合作用、蛋白代谢等,而后者的结果表明CHI、CHS是‘武夷奇枞18’紫叶表型的主要调控者,它们的高表达促进了花青素的积累,并且结果还显示相对于成熟绿叶,幼嫩紫叶中茶氨酸合成相关的谷氨酰胺合成酶(GS)也高丰度表达,这可能有助于幼嫩紫叶制出的茶产品的风味提升。
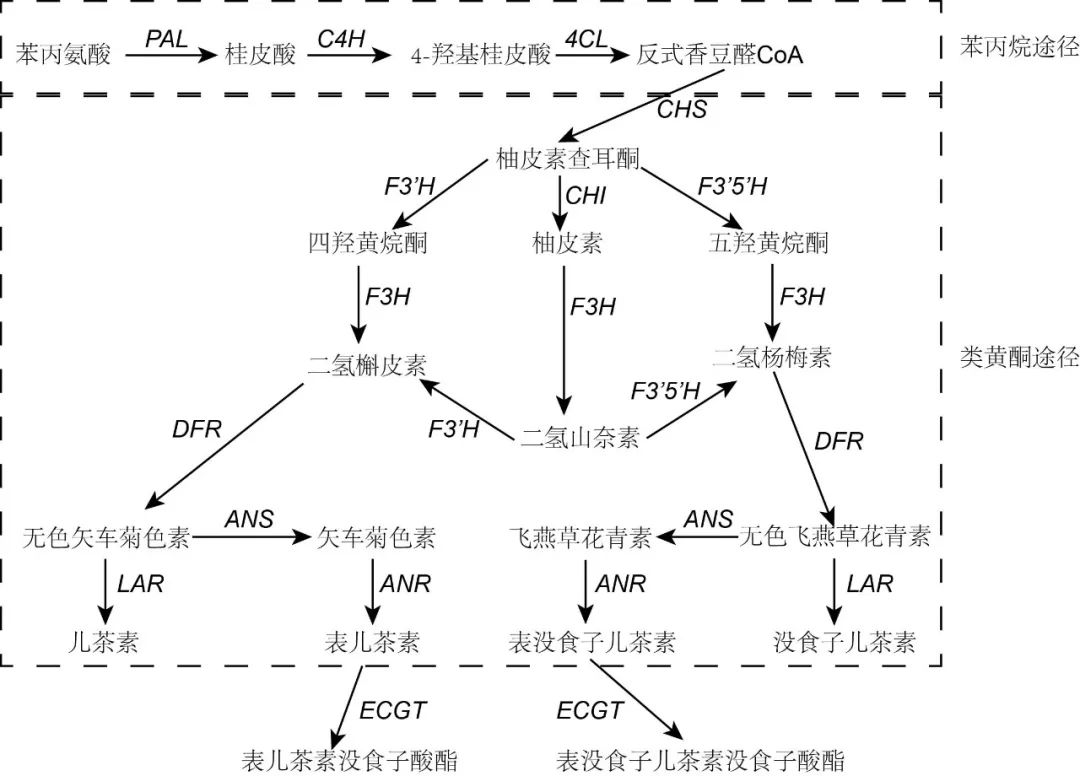
图2. 茶树的儿茶素类合成途径(改自Jin et al. 2017;宛晓春 等. 2015)。
苯丙氨酸解氨酶(PAL)、桂皮醛-4-羟基化酶(C4H)、对香豆酸辅酶A连接酶(4CL)、查尔酮合成酶(CHS)、查尔酮异构酶(CHI)、类黄酮3’-羟化酶(F3’H)、类黄酮3’,5’-羟化酶(F3’5’H)、黄烷酮3-羟化酶(F3H)、二氢黄烷醇4-还原酶(DFR)、无色花青素还原酶(LAR)、花青素合成酶(ANS)、花青素还原酶(ANR)、儿茶素没食子酰基转移酶(ECGT)。
1.2 从组学研究到基因功能分析
Sun等[11]对‘紫娟’不同发育阶段的紫叶比较转录组分析猜测R2R3-MYB转录因子基因CsAN1很可能是‘紫娟’叶片中花青素积累的主要调控基因,功能分析发现CsAN1能够与bHLH转录因子基因CsGL3和 CsEGL3互作,而CsGL3和 CsEGL3又能与WD转录因子基因CsTTG1互作,进而形成MYB-bHLH-WDR (MBW)蛋白复合体调控花青素的积累,另外,低温和长光照能够诱导CsAN1基因启动子的脱甲基化作用,进而导致CsAN1上调表达促进叶片中花青素积累。‘Mooma1’是从‘龙井43’自然杂交群体中获得的一个紫芽茶树品种,其芽和嫩叶呈现亮红色,与‘龙井43’相比,其紫叶中花青素和糖基化黄酮醇的含量显著积累,但是总儿茶素却略微减少,比较转录组分析发现类黄酮合成相关的结构基因在紫叶中并没有显著上调,只有一些调控类黄酮半乳糖苷化的基因CsUGTs表现出显著上调,其中CsUGT72AM1上调最为明显;而根据拟南芥中MYB-bHLH-WD40 (MBW)复合体调控花青素积累,从差异表达基因中筛选发现只有AtMYB113 的同源基因CsMYB6A显著上调表达,而后分别异源表达CsUGT72AM1和CsMYB6A,功能分析进一步表明前者很可能参与茶树糖苷化类黄酮的合成,而后者能够促进花青素的积累,这也预示着MBW复合体在调控花青素积累方面在不同植物间具有功能保守性[16]。在后续的一项研究中,该研究团队根据拟南芥中已经证实的调控花青素或者原花青素合成五种MBW复合体形式(PAP1(MYB75)–TT8/GL3–TTG1(WD40)、PAP2(MYB90)–TT8/GL3–TTG1、 PAP3(MYB113)–TT8/GL3–TTG1、 PAP4(MYB114)–TT8/GL3–TTG1和TT2 (MYB123)–TT8/GL3–TTG1),分别同源克隆了茶树中的WD40同源基因CsWD40、MYB75的同源基因CsAN2、TT2同源基因CsMYB5e、TT8同源基因CsTT8和GL3的同源基因CsGL3,酵母双杂交实验表明CsWD40分别能与后四者互作,进一步遗传转化实验表明CsWD40能够恢复拟南芥ttg1突变体的缺失表型,并能单独促进花青素的积累,同时能够与CsMYB5e协同调控花青素和原花青素的积累,该研究证实了MBW复合体在调控茶树花青素和原花青素合成中的重要作用[17,18]。
2 白化(黄化)芽叶茶树资源研究进展
植物白化或者黄化主要是因为遗传因素或者环境因子导致的植物叶绿素缺乏。一般来说,长时间的白化或者黄化最终会导致植物的死亡,但对于茶树来说,其白化或者黄化表型一般只发生在上部幼嫩新稍,其下部的老叶始终保持绿色,而且其白化或者黄化的嫩叶会随着外界环境的变化逐渐转绿[19]。相比于普通的绿色芽叶茶树资源,白化或者黄化的茶树叶片中自由氨基酸和茶氨酸的含量较高、茶多酚、咖啡碱等含量较低,因此制出的绿茶品质相对较好[20,21]。由于白化或者黄化的调控相比于紫芽的调控机制更为复杂,所以目前针对白化或黄化芽叶茶树资源的研究多集中于环境因子对其叶色变化调控的分子机制以及叶色变化过程中茶氨酸、儿茶素以及咖啡碱等次级代谢物含量变化的机制探索,对于其中相关结构基因的功能解析还很缺乏。
2.1 环境因子对白(黄)化芽叶茶树资源特异性状调控机制研究
环境因子,如光照和温度等对白(黄)化芽叶茶树资源叶色表型具有重要影响[22]。‘安吉白茶’,也称‘白叶1号’,是白化芽叶茶树资源的代表。其白化特性受环境温度影响,一般来说,在春季环境温度低于20℃时,其萌发的幼叶呈现白色,当外界环境温度达到23℃以上时,白化的叶片开始逐渐转绿;黄金芽’是黄化芽叶茶树资源的代表,与一般植物在遮阴下逐渐黄化不同,‘黄金芽’的叶片在强光照下呈现明显黄化,而在遮阴或者光照强度降低的情况下黄化程度减弱,因此是一种光照敏感型黄化茶树资源;‘白鸡冠’是另一种黄化茶树资源,其黄化特性与‘黄金芽’类似[23]。Li等[23]同时对比分析了上述三种白(黄)化茶树资源和‘龙井43’及‘福鼎大白茶’两种普通茶树资源的叶片代谢物变化情况,结果显示白(黄)化茶树资源叶片中叶绿素a、b含量远小于普通茶树资源的,而上述三种白(黄)化茶树资源叶片中叶绿素a、b含量则是‘安吉白茶’>‘白鸡冠’>‘黄金芽’;白(黄)化茶树资源和普通茶树叶片的半乳糖代谢、色氨酸代谢、苯丙烷及类黄酮合成代谢存在显著差异,其中前者的糖类、自由氨基酸含量相对提高、而GC、EGCG含量相对降低,此外随着叶片发育,白(黄)化茶树资源的老叶中黄酮类含量大量积累。Wu等[24]利用RNA-seq技术探究了遮阴对‘白鸡冠’的黄化特性的影响,分别从遮阴处理3天和6天的叶片中鉴定到了1993和2576个差异表达基因(DEGs),这些DEGs主要涉及ROS清除、叶绿体发育、光合色素合成、次级代谢以及生物钟系统等,进一步分析表明强光照抑制了‘白鸡冠’中光合系统II(PSII)蛋白PsbR基因的表达,进而影响PSII稳定性、叶绿体发育和叶绿素合成。Liu等[25]对黄化芽叶品种‘郁金香’的黄化叶片和遮阴处理后叶片进行转录组分析,差异基因鉴定表明它们主要涉及叶绿体组织以及强光照响应等;与普通品种相比,‘郁金香’遮阴前后类黄酮和类胡萝卜素等含量变化以及相关基因表达都有明显不同,黄化叶片中类黄酮途径相关基因 CHS、CHI、F3H、F3’5’H的高表达主要促进槲皮素等合成而不是儿茶素类的合成,这也可能是黄化茶树叶片中类黄酮途径基因高表达而儿茶素类含量并不显著提升的原因之一。Song等[26]根据‘黄金芽’适度遮阴后叶片中类黄酮以及胡萝卜素含量增加的现象,通过对比遮阴处理和全光照处理下‘黄金芽’叶片中基因的差异表达情况,共鉴定到207个DEGs,这些DEGs主要涉及蛋白与离子结合以及氧化还原活性等,进一步分析表明遮阴抑制了类黄酮合成相关基因的表达同时诱导了类胡萝卜素合成相关基因的表达,其中类黄酮合成相关基因的表达降低与遮阴后叶片中类黄酮的含量增加一致,叶片中类胡萝卜素含量与类胡萝卜素合成相关基因的表达情况呈现正相关,意味着‘黄金芽’叶片颜色的变化很大程度上取决于类黄酮和类胡萝卜素合成的协同效应。
2.2 白(黄)化茶树资源主要次生代谢物质特异性调控机制研究
白(黄)化茶树资源的白化阶段叶片内含物成分与普通茶树叶片具有显著差别,其中最主要的就是氨基酸含量高而儿茶素类含量较低[27]。Liu等[28]对白(黄)化茶树资源和普通茶树叶片茶氨酸的代谢差异机制进行了探索,重点对17个茶氨酸代谢相关基因在不同茶树资源、不同组织部位的表达模式进行分析,大部分基因在‘黄金芽’和‘安吉白茶’中都上调表达,且在前者中的表达程度显著高于后者;其中CsTS2、CsGS1、CsGDH2的表达与茶氨酸含量呈现正相关,而其他基因则多数情况下呈现负相关,表明茶氨酸的代谢受到相关基因的协同或者拮抗作用共同调节,同时进一步说明了茶树中茶氨酸代谢的复杂性。需要说明的是,最近茶树中茶氨酸合成相关基因茶氨酸合酶基因(CsTSI)已成功克隆并进行了异源转化的功能验证[29],这对推动解析茶树茶氨酸代谢机制具有重要意义。Zhang等[30]对‘黄金芽’中自由氨基酸的代谢调控机制进行了探索,通过比较转录组合代谢组的分析鉴定到了大量差异表达基因和代谢物组分,在初级代谢中,这些差异表达基因涉及糖类、氨基酸、有机酸等代谢过程,黄化叶片中谷氨酸、谷氨酰胺、茶氨酸等氨基酸类含量增加,同时叶片中氨基盐、柠檬酸盐、α-酮戊二酸等得到提升,单糖、多糖以及咖啡碱等含量降低,该结果不仅揭示了光照对‘黄金芽’叶色及内含物成分的影响,同时表明黄化叶片中氨基酸含量提升很可能是由于蛋白分解作用增强、糖酵解作用降低以及除氨基酸之外的含氮成分如叶绿素、嘌呤、生物碱等合成减少。Xu等[31,32]从转录后修饰(Post-translational modifcation ,PTM)角度对‘安吉白茶’的周期性白化机制进行探索,先后对‘安吉白茶’不同白化阶段表达蛋白的赖氨酸琥珀酰化位点和赖氨酸乙酰化位点进行了鉴定,分别从2132个表达蛋白中鉴定到了3530个赖氨酸琥珀酰化位点,从1752个差异表达蛋白中鉴定到3161个赖氨酸乙酰化位点、并对其中1612个蛋白上的2869个位点进行了定量;其中涉及光合作用、碳固定、氨基酸合成、卟啉以及叶绿素代谢相关蛋白的琥珀酰化水平在叶片不同白化阶段存在差异,涉及光合作用和次生代谢的相关差异表达蛋白的乙酰化水平也呈现动态变化,并且琥珀酰化作用和乙酰化作用在叶片不同白化阶段存在重叠。
当然,除了对白(黄)化芽叶特异资源本身的特异机制探索外,还有研究者以这些资源为材料开展了其他方面的研究。比如Li等[33]以‘黄金芽’、‘安吉白茶’、‘迎霜’为材料,根据它们叶片中抗坏血酸(维生素C)含量的差异研究了茶树中抗坏血酸的合成与代谢机制;在另一项研究中以‘黄金芽’和‘迎霜’为材料,探究了茶树Dof家族基因在茶树非生物胁迫下的作用机制[34]。这些相关的研究在本文中不再详述。
3 结语
一直以来,由于茶树本身的特殊性:生长周期长、自交不亲和、遗传背景复杂、基因组大等。许多在模式植物和一般作物中广泛应用的技术方法在茶树的相关研究中还不能适用,这也导致了茶树的相关研究远远落后于一般作物。随着高通量测序技术的发展,为茶树分子生物学研究提供了新的思路和方向,从上文中提到的研究可以看出,基于高通量测序的组学技术方法在茶树相关研究中已展现出强大的应用潜力。根据材料的表型差异利用比较组学方法探索其内在的机制是这类研究的一般模式,因此对于表型差异鉴定的准确性决定着研究结果的准确性,而叶色特异茶树资源具有明显的表型差异,因此一定程度上推动了相关技术在茶树中的应用。
植物的表型是基因与环境相互作用的结果,从基因层面来说往往是一系列基因形成共表达网络通过相关信号通路进行调控的[35]。对这些特异资源相关调控基因的功能解析是明晰其调控机制的重要前提,同时也是有目的进行育种应用的保证。目前对于茶树来说,相关调控基因的挖掘还处于起步阶段,基因功能的解析也很有限。近年来,茶树两种主要栽培种阿萨姆种和中国种的基因组序列相继测序完成[36,29],这必将会推动茶树分子生物学研究上升的新的阶段。在后续的研究中,这些叶色特异茶树资源仍然会是茶树功能基因挖掘、茶树主要次生代谢调控机制解析的重要研究材料。

责任编辑:千鹤茶苗